Hvordan cellekjernen vokter sine porter
Evolution news; 21. juni 2018
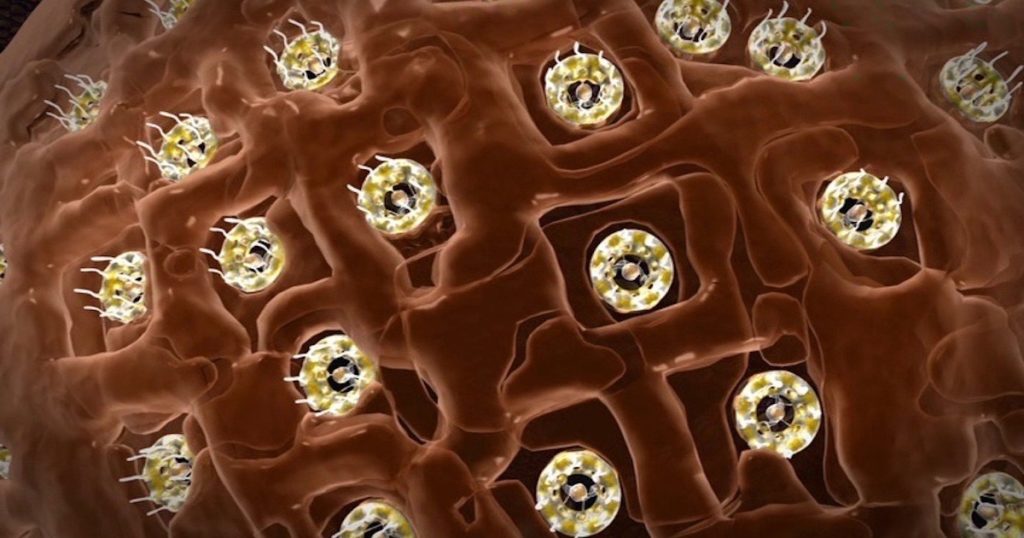
Kjernepore-komplekset (i cellen), som vi nevnte kort her, har vært et hovedmål for forskning i flere år nå, siden biokjemikere skjønte hvor stor den er og den viktige rollen den spiller for å bevare det som beveger seg inn og ut av kjernen . NPC må validere lasten stor og liten gjennom sin hengslede åpning med dinglende ender som ligner et basketballnett. Caltech-forskere beskriver det med ord som lyder klar for en avhandling om intelligent design:
--Stående på vakt mellom en cellekjerne og hoved-kammeret, kalt cytoplasmaet, er tusenvis av store-proteinstrukturer kalt nukleære porekomplekser eller NPC. NPC er som dørvakter for celle-kjernen, og som tett nøyaktig vokter hva som går inn og ut. Hver struktur inneholder om lag 1000 protein-molekyler, noe som gjør NPCs til noen av de største protein-kompleksene i kroppene våre. En av de mest bemerkelsesverdige klientene til NPC er en klasse molekyler kjent som messenger-RNAer, eller mRNAer. Disse er sendebudene som bærer genetiske instruksjoner fra kjernen til cytoplasma, hvor de deretter oversettes til proteiner.
Videre fortsetter artikkelen med å si, mRNA, selv om det er en av de største lastene som fraktes gjennom NPC, skjer hele prosessen gjennom en brøkdel av et sekund. Det er utrolig. Et stort skip som fraktes gjennom Panamakanalen ville elske den slags effektivitet!
 Et stort "uløst problem i biologi"
Et stort "uløst problem i biologi"
Caltech-forskerne forfulgte nye måter å se på mRNA-forflytning, fordi "Hvordan dette virker har vært en av de største uløste problemene i biologi." For å gjøre noen fremskritt, fant de ut måter å merke noen av hundrevis av proteiner involvert med fluorescerende strekkoder og avbilde dem i etapper. Dette tillot dem å bygge opp en grov tids-og-bevegelses-undersøkelse av en messenger-RNA som passerer gjennom "låsene" til NPC-kanalen.
NPC har egne tagger. Et molekyl kan ikke komme seg gjennom uten billett.
--I en ny studie i 13. juni-utgaven av Nature Communications , rapporterer Hoelz og hans gruppe ... den første atomære skalaen på de spesifikke komponentene av menneskelige NPCer som er ansvarlige for å slippe mRNAer av i cytoplasma. For at en mRNA skal transporteres gjennom en NPC, må den være merket med et kjerne-eksport merke , en type av et lite protein. Den taggen er som en billett som lar mRNA komme inn i den sentrale transportkanalen til NPC. Når mRNA når den cytoplasmatiske siden, må den overgi billetten - ellers kan mRNA reise tilbake til kjernen, og proteiner det koder ville ikke bli tillaget.
Det var nok av en utfordring å finne ut det ene trinnet, hvordan billetten blir overgitt. For å studere det måtte de finne ut krystallstrukturen til menneskelig Gle1, en viktig del av NPC-valideringssystemet. Til forskjell fra motparten i gjær ble Gle1 funnet å være stabilisert av Nup42, en av dusinvis av "nukleo-poriner" (Nup) proteiner. Et annet protein kalt DDX19 av-merker molekylet når det kommer ut.
Video med NPK -her.
Fotobombe av Darwin
 Forskerne undret seg over at gjær-Gle1 var nesten identisk med menneskelig Gle1. Caltech tilbyr roterende bilder av proteiner. De er vanskelig å skjelne fra hverandre. Det var da Darwin kom inn for en kort fotobombe, eskortert av Daniel Lin, en Caltech graduate nå på MIT.
Forskerne undret seg over at gjær-Gle1 var nesten identisk med menneskelig Gle1. Caltech tilbyr roterende bilder av proteiner. De er vanskelig å skjelne fra hverandre. Det var da Darwin kom inn for en kort fotobombe, eskortert av Daniel Lin, en Caltech graduate nå på MIT.
"Selv med milliarder års evolusjon mellom gjær og mennesker , er det fortsatt aspekter av vårt biomaskiner som forblir det samme," sier Lin.
Artikkelen i Nature Communications https://www.nature.com/articles/s41467-018-04459-3 , forresten, er bemerkelsesverdig for sin gjentatte omtale av genetisk bevaring - ikke evolusjon - mellom de to formene av Gle1. Av åtte treff på ordet "evolusjon" i papiret sier hele syv av dem "evolusjonært konservert", noe som betyr at ingen utvikling har skjedd. Og den siste omtalen vil ikke gi trøst til darwinister:
--Slående nok er Gle1CTD • Nup42GBM- interaksjonsmekanismen praktisk talt identisk i arter som er adskilt av mer enn en milliard års evolusjon.
For en prosess som tilsynelatende fører til kontinuerlig gradvis endring, er det faktisk "slående". De prøver å forklare det bort:
"Gle1 er viktig for livet å fungere skikkelig," sier Hoelz, "slik at eventuelle mutasjoner som gjør at den blir mindre stabil, kommer til å forårsake problemer."
Denne rasjonaliseringen fører til oppfølgingsspørsmål. Er noen prosesser ikke essensielle for livet? Så hvorfor utviklet "overlevelse av de mest-egnede" dem? Har Gle1 nådd mutasjonelt nirvana, slik at det ikke er mulig å foreta ytterligere endringer? Så hvordan fungerte det før det nådde perfeksjon? Er ikke mutasjoner 'såkornet' til innovasjon? Hvorfor, sier de da at mutasjoner forårsaker problemer? Mutasjoner skaper faktisk problemer:
--NPC er forbundet med flere sykdommer . Mutasjoner til proteiner i komplekset har vært knyttet til motor-neuron sykdommer som Amyotrofisk LateralSklerose (ALS), og personer med Huntingtons sykdom er kjent å ha feil i funksjonen av deres NPC.
Du vil ikke rote med en ikke-utviklet, konservert, effektiv mekanisme som NPC-translokasjon. Men nok om evolusjon.
 La oss se etter design i artikkelen
La oss se etter design i artikkelen
Fire eksempler på "effektivt" kan ses i papiret, for eksempel "En del av dette gapet kan forklares av en bestemt romlig organisasjon på cytoplasmatisk grensesnittet for NPC som effektivt akselererer DDX19-syklusen." Vi finner også hyppige designord som arkitektur , informasjon og organisering . Her er et godt eksempel for å inspirere ærefrykt for NPC som bruker ordet "dekorere" i forbifarten. (Merk: MDa eller MegaDalton er et mål for molekylmasse hvor en Dalton er en atommasse. En kda eller kilodalton tilsvarer omtrent 333 aminosyrer. En MDa er tusen ganger større.)
--Strømmen av genetisk informasjon krever at nye transkriberte og behandlede mRNAer skal eksporteres fra kjernen til cytoplasma gjennom nukleære porekomplekser (NPCer). NPC er massive makromolekylære maskiner som perforerer den kjernefysiske konvolutten, som hver består av ~ 1000 proteinunderenheter (kollektivt kalt nukleo-poriner) til en molekylvekt på ~ 120 MDa hos mennesker . Ved å smelte de indre og ytre atommembraner, oppretter NPCer porene gjennom kjernekuvertet og genererer samtidig en passiv diffusjonsbarriere sammensatt av uordnede proteinsekvenser, beriket i fenylalanin-glycin (FG) gjentakelser. Hver NPC består av en ~ 60 MDa symmetrisk kjerne som er dekorert av forskjellige proteiner på dens nukleære og cytoplasma grensesnitt, som refereres til som henholdsvis nukleo-porinene i nukleær kurv og cytoplasmatisk filament nukleo-poriner (fig. 1a).
Vi lærer også at:
--Forberedelse av mRNA for kjerneksportering er en høyt koordinert prosess som begynner ko-transkripsjonelt og resulterer i tilsetning og fjerning av mRNA-bindende proteiner under transkripsjon og nukleær prosessering inntil en eksport-kompetent messenger ribonukleo-proteinpartikkel (mRNP) dannes.
Flere nivåer av kvalitetskontroll kan sees i handlingen her. Billettprosessen starter når genet transkriberes. Det er re-sjekket av "kjernefysisk bearbeiding" inni kjernen. Først når mRNA'en er "eksport-kompetent", kan den passere NPC. Når den går gjennom, blir billetten fjernet, slik at den ikke kommer tilbake. "Denne romlige reguleringen av aktivitet forhindrer reimport av mRNPs i kjernen, og sikrer dermed retningen av mRNA-eksport." NPC har alle kjennetegn på et programmert system med innebygd kvalitetskontroll. Det er veldig raskt, arbeider i bare brøkdeler av et sekund. Det er selv miljøvennlig; alle delene blir resirkulert. Og det er tusenvis av disse små fabrikkene i hver kjerne-konvolutt. Da er det dette mindre koordinasjonsmiraklet: Ved celledeling blir hele kjerne-konvolutten, med alle sine NPC, revet ned og rekonstruert.
En dag er det kanskje ikke lenger nødvendig å 'tagge' Darwin inn i vitenskapelige artikler som ellers viser gode eksempler på design. Med mindre du er i ferd med å dø av en dødelig NPC-sykdom, forårsaket av en mutasjon, er dine NPCs sannsynligvis alle som de burde, som de gjorde i foreldrene dine, besteforeldrene dine, og så langt tilbake som du kan se. Det er et nivå av automatisert, programmert design langt overlegent noe mennesker har oppnådd.
Oversettelse og bilder ved Asbjørn E. Lund.
 Et stort "uløst problem i biologi"
Et stort "uløst problem i biologi" Forskerne undret seg over at gjær-Gle1 var nesten identisk med menneskelig Gle1. Caltech tilbyr roterende bilder av proteiner. De er vanskelig å skjelne fra hverandre. Det var da Darwin kom inn for en kort fotobombe, eskortert av Daniel Lin, en Caltech graduate nå på MIT.
Forskerne undret seg over at gjær-Gle1 var nesten identisk med menneskelig Gle1. Caltech tilbyr roterende bilder av proteiner. De er vanskelig å skjelne fra hverandre. Det var da Darwin kom inn for en kort fotobombe, eskortert av Daniel Lin, en Caltech graduate nå på MIT. La oss se etter design i artikkelen
La oss se etter design i artikkelen